Diagrama de Davenport
En el estudio de la fisiología ácido-base, el diagrama de Davenport es una herramienta gráfica, desarrollada por Horace W. Davenport, que permite a los médicos clínicos o investigadores describir las concentraciones sanguíneas de bicarbonato y el pH sanguíneo durante los trastornos del equilibrio ácido-base. En el diagrama se grafica una superficie tridimensional que representa todos los estados de equilibrio químico posibles entre el dióxido de carbono (CO2) gaseoso, el bicarbonato (HCO3-) en solución y la concentración de protones (H+) en la interfase entre el alveolo pulmonar y el capilar alveolar. Aunque la superficie del gráfico se determina en forma experimental, el diagrama de Davenport es, principalmente, una herramienta conceptual que permite prever los efectos que tendrán cambios en la química ácido-base sanguínea. Rara vez se usa este diagrama en la práctica médica.
Derivación[editar]

Cuando se expone una muestra de sangre a la atmósfera, ya sea en el alveolo pulmonar o en un experimento in vitro, el dióxido de carbono (CO2) del aire se equilibra rápidamente con los derivados del CO2 y otras especies presentes en la solución acuosa. La figura 1 ilustra las reacciones de equilibrio del dióxido de carbono en sangre más importantes, en relación con la fisiología ácido-base. Al combinarse con el agua (H2O), el CO2 forma el ácido carbónico (H2CO3), que rápidamente se disocia a bicarbonato (HCO3-) y protón de hidrógeno (H+). Los protones liberados en esta ecuación pueden ser captados por bases (representada por B-), formando el ácido conjugado HB.
Nótese que en esta ecuación, el sistema de tamponamiento o buffer, HB/B-, representa todos los buffers no-bicarbonato presentes en la sangre, tales como la hemoglobina en sus distintos estados de protonación. Dado que en la sangre humana se hallan varios buffers no-bicarbonato, el equilibrio final alcanzado a cualquier presión parcial de CO2 (pCO2) es altamente complejo y no puede predecirse fácilmente solo sobre la base de consideraciones teóricas. Al representar resultados experimentales, el diagrama de Davenport provee un enfoque simplificado, facilitando la descripción de estos sistemas complejos.

La figura 2 muestra un diagrama de Davenport tal como se suele representar en la literatura. Para poder interpretarlo, resulta útil entender cómo se obtiene. Considérese la siguiente experiencia. De un paciente sano se obtiene una pequeña muestra de sangre y ésta se coloca en una cámara en la cual la pCO2 se mantiene a un valor constante de 40 mmHg. Una vez que se alcanza el equilibrio, se determinan el pH y la concentración de bicarbonato y se representa tal como se muestra en la Fig. 3.

Luego, manteniendo constante la pCO2 en la cámara, se cambia el pH de la muestra de sangre, primero mediante la adición de un ácido fuerte, luego añadiendo una base fuerte. A medida que se varía el pH, se obtiene una curva de titulación para la muestra (Fig. 4). Nótese que esta curva de titulación solo es válida a una pCO2 de 40 mmHg, ya que la cámara se mantuvo a esta presión parcial durante todo el experimento.

Ahora, imagine que se obtiene una muestra nueva e idéntica de sangre del mismo paciente. Esta vez, sin embargo, en lugar de colocar la muestra en una cámara con una pCO2 de 40 mmHg, la pCO2 de la misma se fija en 60 mmHg. Luego de alcanzado el equilibrio, se obtiene un nuevo punto, indicando un nuevo valor de pH y una nueva concentración de bicarbonato (Fig. 5). Obsérvese que la concentración de bicarbonato a la nueva pCO2 es mayor que en la primera determinación, mientras el pH ahora toma un valor más pequeño (es decir, más ácido). Esto es lo que se esperaría, ya que incrementar la pCO2 implica que la cantidad total de dióxido de carbono en el sistema aumenta. Dado que el dióxido de carbono gaseoso se halla en equilibrio con los derivados del mismo en la solución (véase Fig. 1), las concentraciones de estos derivados del dióxido de carbono, incluyendo al ion bicarbonato, también se incrementaran. La caída del pH tampoco sorprende, dado que la formación de bicarbonato se acompaña de la disociación de un protón.

Si este mismo experimento se repite a varias pCO2, se obtendrá una serie de puntos. Es posible trazar una recta a través de estos puntos, a la que se llama curva de amortiguación (Fig. 6).

La curva de amortiguación puede ser usada para predecir el resultado de variar la pCO2 dentro de un intervalo próximo a los puntos determinados experimentalmente. Adicionalmente, puede realizarse un experimento de titulación para cada punto experimental, en el que se varía el pH mientras la pCO2 se mantiene constante, obteniéndose una curva de titulación para cada una de las pCO2 (Fig. 7). En el diagrama de Davenport, estas curvas de titulación son llamadas isobaras, porque son generadas a una presión parcial constante.

Un concepto clave para entender un diagrama de Davenport es el hecho de que a medida que se incrementa la pCO2, la magnitud del cambio de pH resultante depende de la capacidad amortiguadora de los buffers no-bicarbonato presentes en la solución. Si se hallan presentes buffers no-bicarbonato con gran capacidad amortiguadora, estos absorberán rápidamente la mayoría de los protones liberados durante la formación de bicarbonato, y el pH variarará muy poco para un incremento dado en la concentración de bicarbonato. El resultado será una curva de amotiguación con una pendiente muy pronunciada (Fig. 8). Por otro lado, si la solución solo tiene buffers no-bicarbonato de baja capacidad amortiguadora (o si no contiene otros buffers más que el sistema bicarbonato-ácido carbónico), entonces se observara un cambio mucho mayor en el pH para una variación dada de la concentración de bicarbonato, y la curva de amortiguación tendrá una pendiente que tiende a cero.

Resulta instructivo notar que, bajo condiciones de equilibrio, la pendiente de curva de amortiguación nunca será igual a cero (es decir, nunca será horizontal), aun con ausencia completa de buffers no-bicarbonato. Esto se debe a que la producción de protones resultante de un incremento en la pCO2 se acompaña de la producción de iones bicarbonato, como se mencionó anteriormente. Así, una disminución del pH como resultado de un incremento en la pCO2 siempre se acompañara de, al menos, un mínimo incremento en la concentración de bicarbonato. Asimismo, y por razones similares, un incremento en el pH siempre ocurrirá conjuntamente con un descenso de la concentración de bicarbonato.
El diagrama de Davenport es una representación bidimensional de una superficie tridimensional[editar]
Recuérdese que la relación que se representa en un diagrama de Davenport es la existente entre tres variables: PCO2, concentración de bicarbonato y pH. Así, la Fig. 7 puede pensarse como un mapa topográfica -esto es, una representación bidimensional de una superficie tridimensional- donde cada isobara indica una presión parcial o "altitud" diferente.
Una representación más exacta involucraría tres ejes. La figura 9 muestra un diagrama de Davenport en tres dimensiones. Las líneas celestes indican las isobaras como se encontrarían normalmente en un plano bidimensional. Las curvas azules oscuras muestras las ubicaciones reales de las isobaras en tres dimensiones. Así, las líneas celestes solo son proyecciones a un plano bidimensional de las isobaras en el espacio tridimensional. Recuérdese nuevamente que una isobara es una curva de titilación -esto es, la curva que es trazada si se varía el pH mientras la PCO2 se mantiene constante. La superficie verde describe todas las combinaciones de PCO2, [HCO3-] y pH que satisfacen el equilibrio para el sistema. Todas las isobaras en su representación tridimensional deben estar confinadas a esta superficie.

Un segundo concepto importante es que un cambio a lo largo de la curva de amortiguación debe corresponderse con un cambio en la PCO2. Así, como las isobaras, la curva de amortiguación típica de un diagrama de Davenport (ej, Fig. 6) es en realidad una proyección de una curva existente en un espacio tridimensional al plano bidimensional. Como con las isobaras, las curvas de amortiguación en su representación tridimensional deben hallarse confinadas a las superficies que representas los valores de PCO2, [HCO3-] y pH que satisfacen la condición de equilibrio. En la Fig. 10, las líneas rojo oscuro representan las curvas de amortiguación en su representación tridimensional, mientras que las líneas rojo claro son las proyecciones de estas curvas en el plano bidimensional. (Más tarde se veras como pueden determinarse múltiples curvas de amortiguación paralelas para un sistema dado.)

Alteraciones ácido-base respiratorias y metabólicas[editar]
Una de las características más importantes de un diagrama de Davenport es su utilidad para representar el movimiento desde un punto de la superficie de equilibrio a otro luego de ocurrir un cambio en la respiración o en el metabolismo. Cuatro son los cambios fundamentales que pueden afectar el balance ácido-base del organismo: acidosis respiratoria, alcalosis respiratoria, acidosis metabólica y alcalosis metabólica. Además, pueden ocurrir alteraciones respiratorias y metabólicas en forma simultánea, tal como acidosis respiratoria seguida de una alcalosis metabólica compensatoria.
Alteraciones respiratorias[editar]
Para entender como un cambio en la respiración puede afectar el pH sanguíneo, considérese los efectos de la ventilación pulmonar sobre la PCO2. Si uno mantiene el aliento (o respira muy lentamente, como en el caso de la depresión respiratoria), la sangre continuara liberando dióxido de carbono a los alvéolos pulmonares, y la cantidad de dióxido de carbono a nivel pulmonar se incrementara. Por otro lado, si uno hiperventila, entonces se renovara el aire alveolar y el dióxido de carbono se eliminara con rapidez. En el primer caso, dado que se acumula dióxido de carbono a nivel pulmonar, la PCO2 alveolar alcanzara valores muy altos. En el segundo caso, dado que el dióxido de carbono se elimina rápidamente de los pulmones, la PCO2 alveolar será muy baja. Nótese que en estas dos situaciones se producen efectos que son análogos a los experimentos descriptos previamente, en los que se variaba la presión parcial de dióxido de carbono y se observaba el cambio resultante en el pH. Como indica el diagrama de Davenport, la depresión respiratoria, que resulta en una PCO2 alta, disminuirá el pH sanguíneo. La hiperventilación tendrá efectos opuestos. Un descenso del pH debido a una depresión respiratoria se llama acidosis respiratoria. Un aumento del pH debido a hiperventilación se conoce como alcalosis respiratoria (Fig. 11).

Alteraciones metabólicas[editar]
Los cambios en la composición metabólica de la sangre también pueden afectar el pH. Nuevamente, recuérdese de nuestro experimento inicial que si se añadía un ácido o base fuerte a la muestra de sangre, el pH y la concentración de bicarbonato cambiaban en concordancia, resultando en una curva de titilación. Cuando se añade, por ejemplo, iones hidróxido a la solución, estos reaccionaran son los protones libres y se incrementara el pH de la solución. Adicionalmente, los iones hidróxido extraerán protones del ácido carbónico de la solución, causando un incremento de la concentración de bicarbonato. Luego de la adición de iones hidróxido la nueva posición en el diagrama no se encontrara sobre nuestra curva de amortiguación original. Sin embargo, si se varía la PCO2 sin añadir más ácido o base fuerte a la solución, puede determinarse una nueva curva de amortiguación que se encontrara sobre la curva de amortiguación original y será, aproximadamente, paralela a esta.
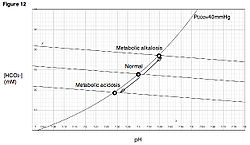
En forma similar, en un sistema fisiológico tal como el cuerpo humano, la remoción de protones mediante, por ejemplo, la eliminación del contenido ácido del estómago (por vómitos, por ej.), resultara en un incremento del pH y de la concentración de bicarbonato, llevando el sistema a una nueva curva de amortiguación que se hallara en una posición superior respecto a la anterior. Tal alteración se conoce como alcalosis metabólica (Fig. 12). En forma alternativa, si se añaden protones al torrente sanguíneo en la forma de metabolitos ácidos, como ocurre durante la cetoacidosis diabética, el pH disminuirá así como la concentración de bicarbonato. Este tipo de alteración se llama acidosis metabólica. En este último caso, la nueva curva de amortiguación se hallara por debajo de la curva original.
Referencias[editar]
- Davenport, Horace W. (1974). The ABC of Acid-Base Chemistry: The Elements of Physiological Blood-Gas Chemistry for Medical Students and Physicians (Sixth ed. edición). Chicago: The University of Chicago Press.
- Boron, Walter F. and Boulpaep, Emile L. (2003). Medical Physiology: A Cellular and Molecular Approach. Philadelphia: Saunders.
